Met een insuline-injectie voorkomt een diabetespatiënt een te hoge suikerspiegel, met een suikerklontje een te lage. Maar wat als het lichaam geen waarschuwingssignalen afgeeft bij een suikertekort? Dat kan fataal aflopen.
Glucose is de brandstof van ons lichaam: bijna al onze cellen gebruiken het. Veel cellen verbranden ook vetzuren, maar de hersenen – met hun grote energiebehoefte – moeten echt glucose krijgen. Dat kunnen ze zo uit het bloed halen: ons lichaam zorgt dat de glucoseconcentratie daarin zo weinig mogelijk schommelt.
Terwijl de suikerbehoefte in het lijf tamelijk constant is, is de aanvoer ervan dat beslist niet. Koolhydraten in het voedsel vormen de belangrijkste glucosebron. De eerste uren na het eten van chocola of een koek belandt er vanuit de darmen veel glucose in het bloed. Het glucosegehalte stijgt dan sterk, maar gelukkig komt het hormoon insuline uit de alvleesklier op tijd in actie. Het zorgt dat de lever, de spieren en het vetweefsel glucose opslaan voor schralere momenten. Dreigt de glucoseconcentratie te laag te worden, dan gaat de alvleesklier glucagon produceren. Glucagon is de tegenpool van insuline: het zorgt dat vet- en spierweefsel stoppen met het opslaan van glucose en het stimuleert de lever tot het afgeven ervan.
Zoet evenwicht. Een diabetespatient voorkomt met een insulineinjectie dat na het eten de suikerspiegel teveel stijgt. Insuline zorgt dat het lichaam de koolhydraten opslaat, glucagon laat het weer vrijkomen als het nodig is.
Een prachtig systeem, die automatische suikerregulatie. Dat realiseer je je vooral als je kijkt naar de problemen die diabetici erbij ondervinden. Bij hen gaat het namelijk niet automatisch, want ze maken niet of nauwelijks insuline aan of hun insuline werkt niet meer. Zonder bijsturing van buitenaf loopt de glucoseconcentratie in hun bloed te ver op. De bloedvaten raken daardoor aangetast, wat een hartinfarct of beroerte in de hand werkt. Ook ogen, nieren en zenuwen lopen gevaar.
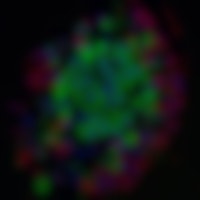
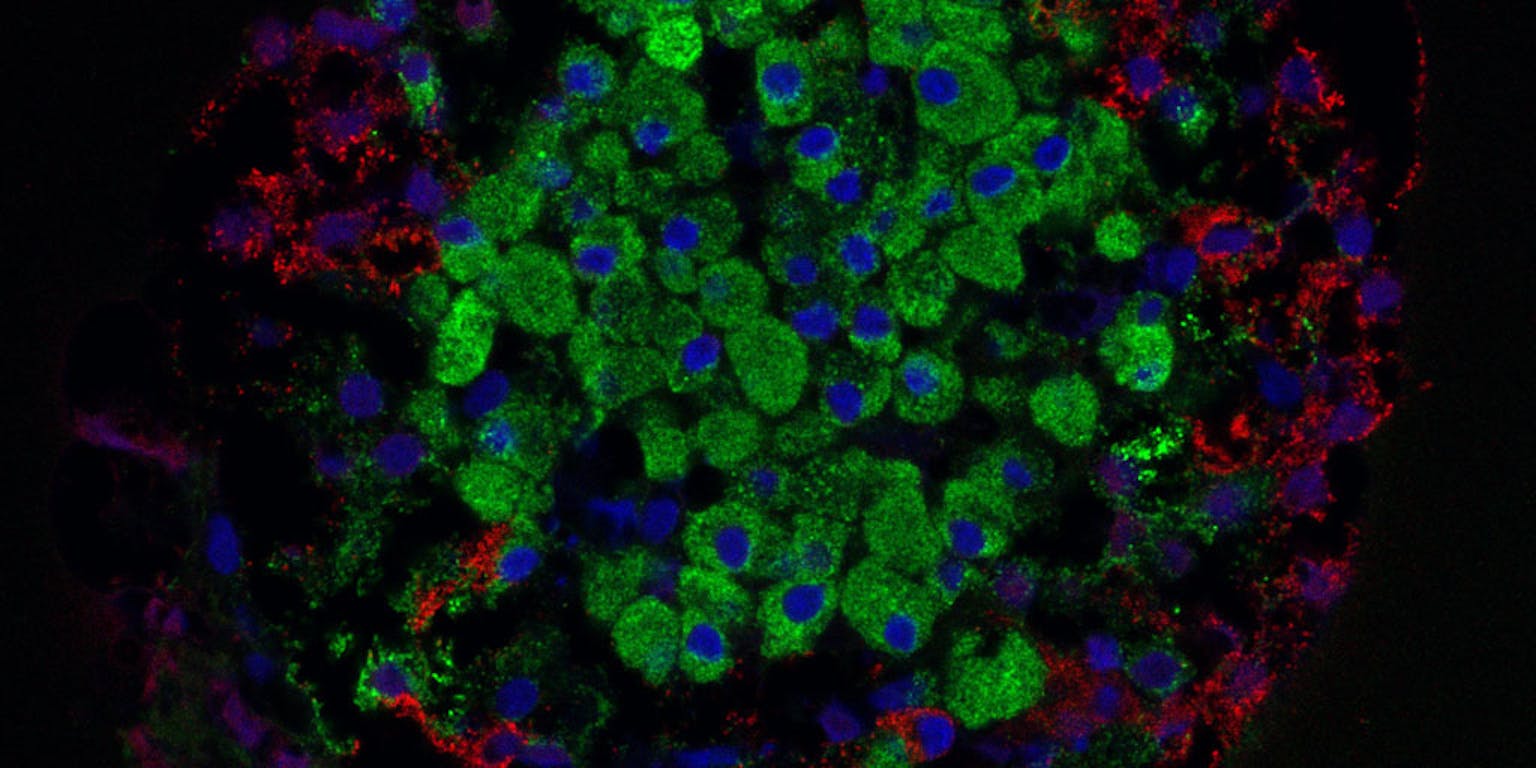
Eilandje. In de alvleesklier produceren cellen in de eilandjes van Langerhans diverse hormonen. De blauwe cellen maken insuline, de groene glucagon en de rode het groeihormoon somatostatine.
Het genezen van suikerziekte is nog steeds onmogelijk, maar sinds de ontdekking van insuline is volop onderzoek gedaan en nog steeds werken duizenden onderzoekers aan het beter begrijpen van diabetes. Ook wij dragen daaraan een steentje bij, en hopen dat dit oplossingen zal brengen.
Zoete doorloop
Diabetes mellitus betekent letterlijk ‘zoete doorloop’. De ziekte dankt zijn naam aan de verhoogde urineproductie en de aanwezigheid van suiker in de urine die ermee gepaard gaan. Diabetes komt veel voor: vrijwel iedereen kent wel iemand die suikerziekte heeft. In Nederland zijn ongeveer 300.000 patiënten bekend en er zijn er waarschijnlijk bijna net zo veel die niet zijn geregistreerd. In België zijn 163.000 diabeten bekend. Men schat dat een op de dertig mensen in de westerse wereld suikerziekte heeft; wereldwijd zouden er ongeveer 140 miljoen patiënten zijn.
Bijna tien procent van de diabeten heeft type-I-diabetes, ook wel insuline-afhankelijke diabetes genoemd. Deze vorm ontstaat meestal voor het vijfentwintigste levensjaar. Door een auto-immuunreactie vernietigt het eigen lichaam de insulineproducerende cellen in de alvleesklier. Daardoor kunnen de patiënten zelf niet genoeg insuline meer aanmaken en moeten ze het van buitenaf toedienen.
De overige negentig procent van de diabeten heeft type-II-diabetes, ook wel insuline-onafhankelijke of ouderdomsdiabetes genoemd, want het ontstaat vaak na het veertigste levensjaar. Het lichaam van een type-II-diabeet produceert nog wel insuline, maar door verschillende oorzaken is de werkzaamheid ervan verminderd. Deze insulineresistentie is sterk gerelateerd aan overgewicht, roken en erfelijke aanleg.
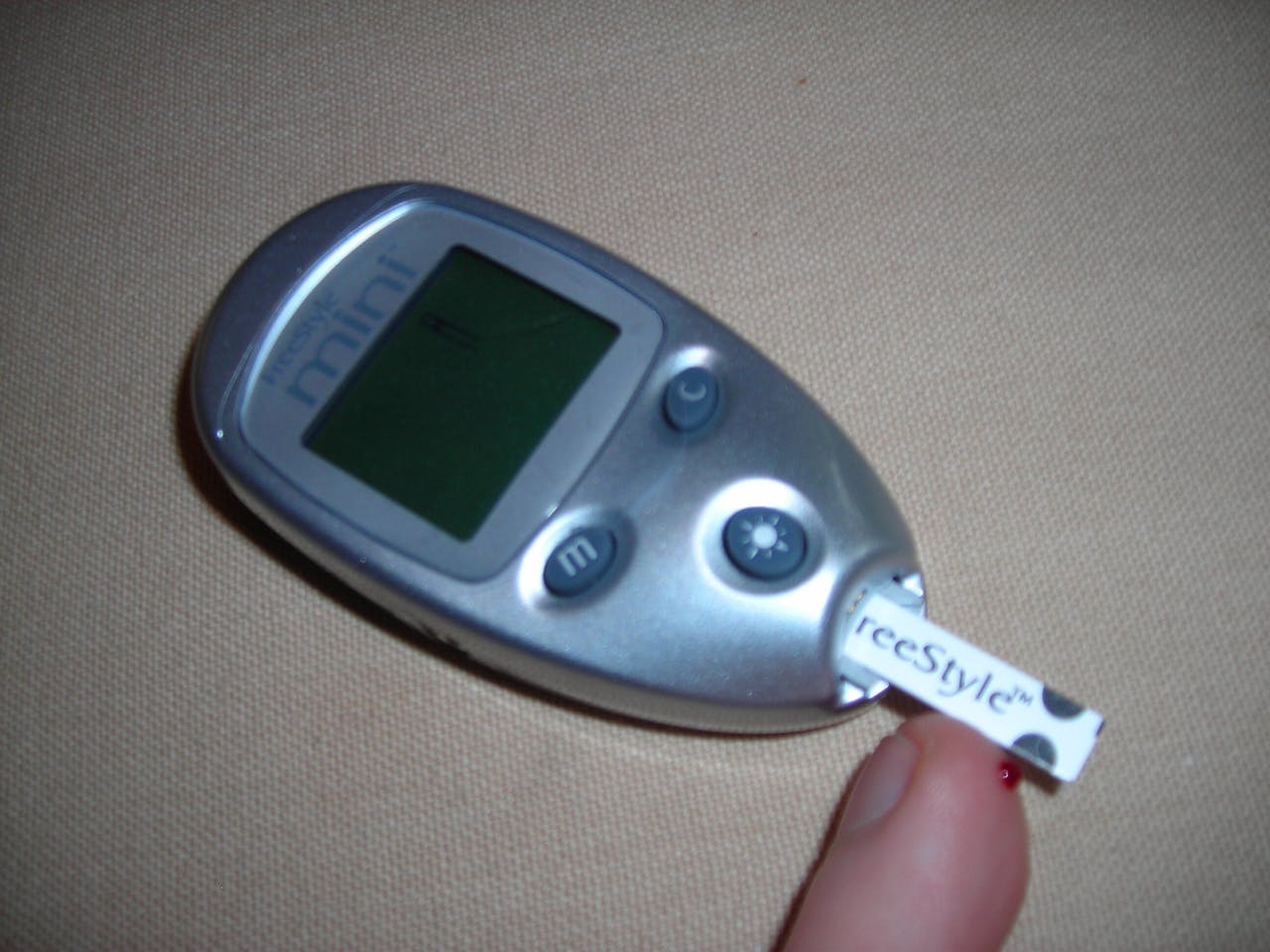
Vingerprik. Diabetici meten meerdere malen per dag de glucosespiegel in een druppel bloed.
Vicieuze cirkel
Suikerpatiënten moeten de schommelingen in hun glucosespiegel zoveel mogelijk beperken. Daarom bootsen ze de variaties in insuline-activiteit zo goed mogelijk na. Veel van hen dienen zichzelf voor de maaltijd insuline toe en houden daarmee de glucosestijging binnen de perken. Afhankelijk van de activiteit van de diabeet moet er wel een resthoeveelheid insuline overblijven voor de perioden tussen de maaltijden en tijdens de nacht. Met een simpele prik in de vinger kan de patiënt regelmatig het glucosegehalte in zijn bloed controleren.
Tussen de maaltijden door kan de glucoseconcentratie in het bloed gevaarlijk dalen. Dat verschijnsel heet hypoglycemie. Gezonde personen kan dat overkomen tijdens grote lichamelijke inspanning: de glucagonwerking komt dan niet snel genoeg op gang om de daling te compenseren. Diabeten krijgen daarnaast ook een ‘hypo’ nadat ze zich teveel insuline hebben ingespoten.
Het lichaam heeft verscheidene compensatiereacties in petto als er een hypo optreedt. Die reacties moeten er voor zorgen dat het lichaam kan blijven functioneren. Ten eerste krijg je honger: je wordt vriendelijk verzocht om extra glucose aan te voeren. Als glucagon alleen onvoldoende suiker in het bloed oplevert, gaan de bijnieren bovendien de hormonen adrenaline en cortisol afgeven. Die zorgen er onder andere voor dat de spieren overschakelen op de verbranding van vetzuren, zodat de hersenen kunnen beschikken over het schaarse glucose.
Injectie
Diabeten kunnen met twee strategieën hun glucoseconcentratie op peil houden. Ten eerste is er de conventionele methode: ze injecteren zichzelf met een mengsel van kort- en langwerkende insuline. Ze doen dat in het algemeen twee keer per dag, voor het ontbijt en voor het avondeten. De kortwerkende insuline onderdrukt de glucosepiek tijdens en na het eten; de langwerkende is belangrijk voor de perioden tussen de maaltijden.
Het probleem van de ‘conventionele insulinetherapie’ is dat diabeten toch nog hogere glucosegehalten in het bloed hebben dan gezonde mensen. Dat geldt vooral voor de rustwaarden tussen de maaltijden door. Dat verklaart waarschijnlijk waarom deze mensen in de loop van de tijd toch de voor suikerziekte kenmerkende gezondheidsproblemen ontwikkelen.
Begin jaren negentig is een tweede strategie voor suikerpatiënten ingevoerd, de zogenaamde ‘intensieve insulinetherapie’. Bij deze therapie dienen diabeten zichzelf vaker insuline toe, meestal drie tot vijf keer per dag. Ze meten vaak hun glucosespiegel, zodat ze deze nauwkeurig kunnen regelen. Op deze manier voorkomen ze een te hoge suikerspiegel en verkleinen daarmee de kans op complicaties. Probleem: hun pogingen tot het verlagen van de glucosespiegel brengt het gevaar met zich mee dat ze doorschieten naar de andere kant. Diabeten die intensieve insulinetherapie toepassen, hebben daardoor drie keer zoveel kans op het ontwikkelen van ernstige hypo’s als diabeten met conventionele therapie.
Suikerklontje
Geen punt, zou je zeggen. Je herkent een hypo immers snel genoeg, zodat je actie kunt ondernemen om erger te voorkomen. Bij een dreigend suikertekort krijg je honger, word je onrustig en ga je beven en zweten als gevolg van de compensatiereacties die je lichaam in gang zet. Als dan ook nog je hersenen een energietekort krijgen, merk je dat snel genoeg aan je gezichtsvermogen. Ook word je wat verward en krijg je spraak- en concentratieproblemen. Wat suikerklontjes eten en klaar, toch?
Nee dus. Om tot nu toe onbekende redenen verminderen de waarschuwingssignalen na elke hypo. Vooral de eerste merkbare verschijnselen, zoals het hongergevoel, treden na een paar keer al niet meer op. Het gevolg is dat je je daardoor steeds minder bewust bent van een opkomende hypo en je er pas later op reageert, waardoor er ook steeds meer hypo’s optreden. Deze vicieuze cirkel leidt er uiteindelijk toe dat een diabeet een daling in het bloedsuikergehalte niet meer tijdig bemerkt en daadwerkelijk hersenfuncties verstoord raken. Daardoor kan hij onverwacht het bewustzijn verliezen. Dat is levensgevaarlijk als er niemand in de buurt is om te helpen. Intensieve therapie met al zijn belangrijke voordelen brengt daarom wellicht een hogere sterftekans met zich mee dan conventionele therapie.
Alcohol
Het verlies van de symptomen die een hypoglycemie aankondigen, noemen we hypoglycemia unawareness. Het is de belangrijkste beperking van het toepassen van de intensieve insulinetherapie. Omdat de conventionele therapie ook niet alles is – vanwege de genoemde gezondheidsproblemen – is het belangrijk dat we de oorzaken van hypoglycemia unawareness kunnen achterhalen en een manier vinden om er iets aan te doen.
Er zijn twee facetten. De lichamelijke reacties op een hypo zijn verminderd, en dat leidt er vervolgens toe dat de patiënt zich minder van een hypo bewust is. Bij hypoglycemia unawareness vermindert het vermogen om de lichamelijke reacties waar te nemen, maar de afgifte van compenserende hormonen is ook lager dan normaal. Die komen pas bij een lager glucosegehalte in actie. De problemen komen van twee kanten: het lichaam corrigeert de lage suikerspiegel slechter en het waarnemingsvermogen van de patiënt neemt af.
Het eerste vereiste voor het ontwikkelen van hypoglycemia unawareness is het meemaken van een hypo. Ook mensen zonder diabetes kunnen zo’n ‘unawareness’ krijgen: toen gezonde proefpersonen in het ziekenhuis in twee dagen drie hypo’s kregen, vertoonden ze de derde keer sterk verminderde hormonale reacties. Deze proefpersonen is niets ergs aangedaan, want als je een tijdje goed oplet en zorgt dat er geen hypo optreedt, verdwijnt de unawareness ook weer.
Diabetici hebben vaker met hypoglycemia unawareness te maken dan gezonde mensen, omdat bij hen meer en hevigere schommelingen in de bloedsuikerspiegel voorkomen. Hoe langer ze al suikerpatiënt zijn, hoe meer kans ze hebben op het ontwikkelen van het verschijnsel. Ook het gebruik van alcohol en medicijnen speelt een rol, maar het is niet bekend hoe al die oorzaken leiden tot hypoglycemia unawareness. Omdat enkele milde hypo’s al de hormoonreacties doen verminderen, speelt uitputting van de hormoonproducerende organen als er vaak een hypo optreedt in elk geval geen rol.
Ratten
Momenteel schenken onderzoekers aandacht aan de hypothese dat de hersenen zich op de een of andere manier aanpassen aan het regelmatige tekort aan glucose. Het autonome deel van onze hersenen speelt een centrale rol in het stofwisselingsproces. Met name een klein gebied midden onderin de hersenen, de hypothalamus, is gevoelig voor veranderingen in de glucosespiegel. Tijdens een hypo neemt de activiteit van de zenuwcellen in de hypothalamus toe. Ze sturen via zenuwen chemische signalen (neurotransmitters) naar de organen die de stofwisselingshormonen als insuline en glucagon maken. De organen reageren door de benodigde hormonen in het bloed te brengen.
Aan de University of Illinois onderzoeken we hoe de hypothalamus reageert op een hypo. We bepalen de zenuwactiviteit door te meten welke neurotransmitters uit de zenuwuiteinden vrijkomen. Met microdialyse (zie kader pagina 57) meten we hun concentraties in de ruimte rond de cellen van de hypothalamus. Met microdialyse kun je de concentraties van neurotransmitters geruime tijd volgen. Zo vonden we onder andere dat een verminderde beschikbaarheid van glucose binnen vijftien minuten zorgt voor een toename in de afgifte van de neurotransmitter noradrenaline. Deze stof zet andere zenuwcellen aan tot het vrijmaken van gamma-amino-boterzuur (GABA). Dat is het begin van een lange reeks signaaloverdrachten waarvan we nu het bestaan alleen maar kunnen vermoeden.
Proefdiermodel
Aan de Rijksuniversiteit Groningen hebben we aangetoond dat het mogelijk is om een vorm van hypoglycemia unawareness op te wekken in ratten. Dat opent de weg naar meer intensief hersenonderzoek, waarbij het meten van glucose en neurotransmitters in de hypothalamus centraal staan. Is er een defect in de communicatie tussen de vele zenuwcellen die bij het aansturen van de hormoonreacties betrokken zijn? Is er juist sprake van een meer efficiënt glucosetransport naar de hersenen, zodat die een daling van het glucosegehalte in het bloed pas veel later waarnemen? En welke rol speelt cortisol bij het ontstaan van unawareness?
Wij beiden hopen de antwoorden te vinden met ons onderzoek en zo een bijdrage te leveren aan het vergroten van het inzicht in de processen die betrokken zijn bij hypoglycemia unawareness. Over de hele wereld onderzoeken vele wetenschappers de oorzaken en gevolgen van suikerziekte. Er zijn veelbelovende ontwikkelingen gaande. Als het onderzoek financieel mogelijk blijft – veel ervan is afhankelijk van giften – zal de kwaliteit van leven voor diabetici aanzienlijk verbeteren.
Microdialyse
Meten op lokatie. Met een microdialyseprobe kun je meten welke neurotransmitters bijvoorbeeld de hypothalamus afgeeft.
Dialyse is gebaseerd op diffusie: een oplosmiddel kan gemakkelijk door een membraan, maar grotere moleculen zoals afvalstoffen kunnen het membraan niet passeren. Dialyse is vooral bekend in verband met nierpatiënten: deze techniek verwijdert bij hen afvalstoffen uit het bloed. In het klein kun je dialyse echter ook toepassen als je de concentraties van bepaalde stoffen in het lichaam wil meten. Ook dan gaat het erom dat bepaalde stoffen door een membraan van de ene naar de andere kant kunnen diffunderen. De techniek van microdialyse is eind jaren tachtig in Zweden ontwikkeld.
De foto toont de meest gebruikte vorm van microdialyse. De zogeheten probe bestaat uit twee dunne buisjes. Helemaal onderaan is het buitenste buisje afgesloten door een membraan dat alleen kleine moleculen zoals suikers, ionen en neurotransmitters doorlaat. Tijdens het gebruik in de hersenen stroomt er een dialysevloeistof door het binnenste buisje naar beneden, die vervolgens de binnenkant van het membraan passeert. Via de grotere buis stroomt de vloeistof terug, verrijkt met de kleine moleculen uit de hersenvloeistof die het membraan kunnen passeren. De terugstromende vloeistof vang je op en analyseer je op de samenstelling.
Microdialyse is vooral geschikt om chemische veranderingen na een behandeling te meten. De eigenschappen van de membraan en de exacte plaatsing van de probe hebben namelijk invloed op de efficiëntie van het opvangproces. Plaats je de probe op een iets andere plek, dan krijg je andere resultaten. Daarom kun je het beste de probe al voor de behandeling plaatsen, vervolgens meten, dan behandelen en dan weer meten.
Suikerziekte: ernstiger dan je denkt
Vooral voor type-I-diabetici is er tot nu toe geen enkele kans is op genezing. Een redelijk normaal leven is wel mogelijk, door het glucosegehalte in het bloed nauwkeurig te regelen met insuline-injecties. Omdat iedereen anders reageert, moet elke patiënt aan het begin van een behandeling eerst worden ‘ingesteld’. Dat betekent dat een arts in het ziekenhuis vaststelt welke therapie en welke dosering het beste resultaat leveren. Diabeten moeten de hoeveelheid insuline die ze inspuiten precies aanpassen aan hun leef- en eetgewoonten. Het levenspatroon van diabeten is daarom onderhevig aan een strakke planning: er is weinig ruimte voor afwijking van de vaste regelmaat. Naast eetgewoonten en lichamelijke activiteit kunnen ook stress en een griepje het evenwicht sterk in de war sturen.
Zonder behandeling hopen zure afvalstoffen die vrijkomen bij de vetverbranding, zoals ketonen, ammonium (NH4+) en melkzuur, zich op in het bloed. Door de hogere zuurgraad raakt de patiënt in coma en zonder onmiddellijke hulp betekent dat de dood.
De noodzaak om zichzelf zo vaak te moeten injecteren, vormt een grote psychische belasting voor veel patiënten. Daarom zoekt men nieuwe behandelmethoden, zoals in de buikholte geïmplanteerde insulinepompjes en transplantatie van de alvleesklier of delen daarvan. Bij type-II-diabetes zijn de gevolgen minder acuut, maar ook hier is bijsturing van buitenaf noodzakelijk. Meestal volstaan een speciaal dieet, met minder koolhydraten en calorieën, en tabletten die de werkzaamheid van de eigen insuline verhogen. Een op de drie type-II-diabeten moet daarnaast toch nog insuline inspuiten.
Al is suikerziekte tegenwoordig goed te behandelen, toch treden er in de loop van de tijd ernstige complicaties op. Typerend zijn aandoeningen aan de bloedvaten: de chronisch verhoogde glucosespiegel beschadigt de endotheelcellen die de haarvaten vormen. De buitenkant van deze kleine adertjes wordt minder doorlaatbaar en omliggende weefsels sterven af. De kans op een hartinfarct of een beroerte neemt daardoor sterk toe. Hoewel ook de rest van het lichaam gevaar loopt, komt vooral beschadiging van ogen, nieren of zenuwen vaak voor.
Volgens het Diabetesfonds Nederland heeft veertig procent van de diabeten een nieraandoening en is diabetes de belangrijkste veroorzaker van bijvoorbeeld blindheid, maar ook van voetamputaties. Dat laatste komt door aantasting van de zenuwen in de voeten, zodat diabeten minder pijn voelen en eerder wonden oplopen. Door de slechte doorbloeding genezen de wonden waarschijnlijk ook nog eens langzamer dan bij gezonde mensen. Ondanks een goede behandeling kunnen deze complicaties toch optreden, en daarmee is suikerziekte ernstiger dan veel mensen denken.