Bij ouderdom komen ook parkinson en alzheimer om de hoek kijken. Voordat iemand zelf in de war raakt, lijkt dat al op celniveau bij eiwitten te gebeuren. Biologen zoeken naar oorzaken en oplossingen.
Als klonters kunnen ze behoorlijk ellende veroorzaken, zoals de ziektes van Alzheimer, Parkinson of Huntington. Maar eiwitten zelf zijn in ons lichaam absoluut onmisbaar. Uit een beperkt aantal bouwblokken bouwen cellen met eiwitten onvoorstelbaar veel structuren op, van beweeglijke spiervezels tot wimperharen. Ook bekende stoffen als insuline en hemoglobine zijn eiwitten. En cellen kunnen ze zelf maken, als knutselplaatsen op microformaat. Het DNA vormt daarbij de bouwhandleiding: de letters op een gen geven aan welke bouwblokken nodig zijn. Die aminozuren worden achter elkaar geplaatst in strengen van tientallen tot tienduizenden blokjes lang.
Zo’n ketting van aminozuren heeft van zichzelf nog geen functie. De streng gaat pas werken zodra die is opgevouwen tot een nuttige structuur, als een platte bouwplaat die door te vouwen z’n vorm krijgt. Eiwitten zijn enorme moleculen, en meestal verzorgen natuurwetten het belangrijkste vouwwerk: bepaalde bouwblokjes trekken elkaar aan, terwijl andere mekaar juist niet kunnen uitstaan. Zo vouwen ze vrijwel automatisch goed, waarna ze aan de slag kunnen.
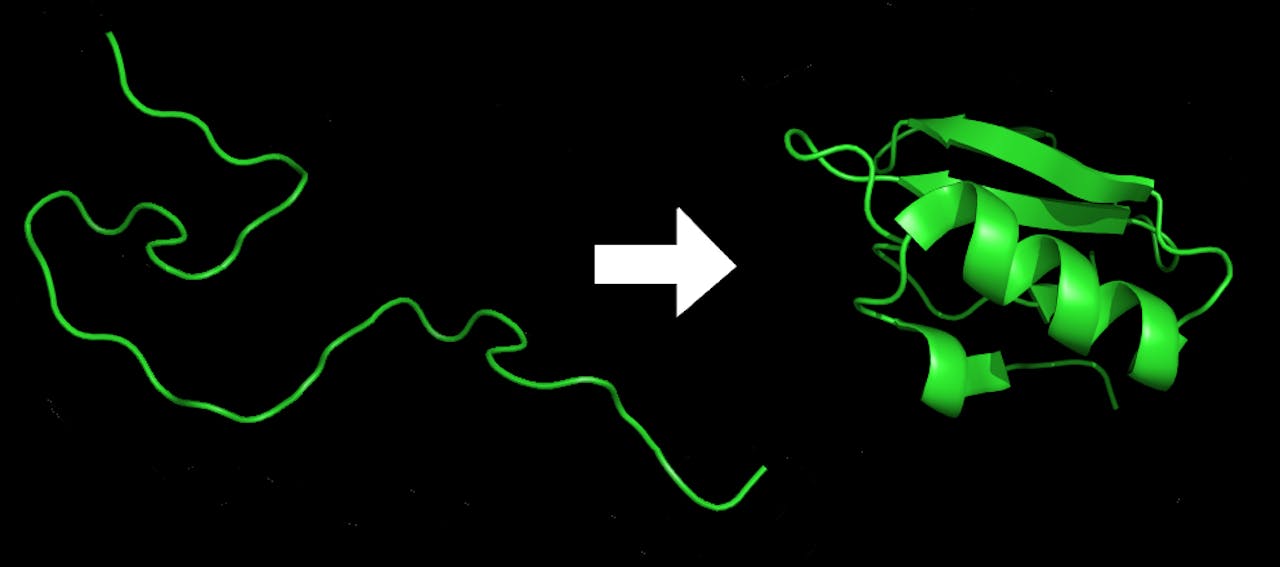
Illustratie van het vouwproces van een eiwit. Links een streng aminozuren, rechts is deze opgevouwen tot een eiwit.
DrKjaergaard, publieke domein via Wikimedia CommonsVerkeerd gevouwen
Dat geknutsel met eiwitten maakt cellen extreem veelzijdig: er bestaan tienduizenden verschillende varianten, die bovendien in hogere of lagere dosering gebouwd kunnen worden. Voorwaarde is wel dat de eiwitten goed opvouwen. Dat gebeurt niet altijd. Het kan onder meer misgaan doordat het propvol is in cellen, vertelt hoogleraar verouderingsbiologie Ellen Nollen van verouderingsinstituut Eriba (Rijksuniversiteit Groningen). “Een cel zit vol eiwitten en andere moleculen. Daardoor is er niet altijd genoeg ruimte om eiwitten goed te vouwen.” Als een lange blokjessliert zich verkeerd opvouwt, eindig je met een niet of slecht functionerend eiwit.
Met name een groep 'intrinsiek ongestructureerde eiwitten' blijkt daar gevoelig voor, vertelt Nollen. “Die hebben al niet zo’n bijster goede structuur en worden extra gevoelig met veroudering.” Dankzij hun flexibele vorm zijn de eiwitten veelzijdig inzetbaar, maar ook foutgevoelig. Verkeerd gevouwen eiwitten hebben de neiging samen te klonteren. Ze zijn namelijk kleverig, alsof de plakrandjes van de bouwplaat naar buiten toe blijven staan. De gevolgen daarvan zijn zichtbaar bij hersenaandoeningen als alzheimer, ALS en parkinson. In hersencellen van patiënten bevinden zich grote hoeveelheden aaneengeplakte eiwitten, die tot strengen zijn samengeklonterd, legt Nollen uit. “Iedere ziekte herken je aan z’n karakteristieke geplakte eiwitten.”
Eiwit beschermt eiwit
Dat zulke eiwitklonten weinig nut hebben is duidelijk. Maar waarom ze de hersenen in de war brengen is veel minder helder. Vormen de eiwitstrengen het probleem, of zijn ze daar slechts het gevolg van? Het samenklonteren gebeurt niet spontaan, vertelt Nollen. “De verkeerd gevouwen eiwitten vormen geen berg proppen in de hoek, maar een keurig stapeltje. Ze eindigen volgens een vaste systematiek in supercompacte vorm, die een beetje op een draad lijkt. Dat lijkt een manier om de schade te beperken.” Door alle misvouwsels te bundelen, lijkt de cel nog even door te kunnen. Maar het samenklonteren blijft gewoonlijk toenemen. Met de jaren valt het probleem mogelijk niet meer weg te moffelen.
— Anne WentinkMisschien moet je een bepaalde hoeveelheid schade op de koop toenemen
Maar misschien gaat het wel mis door een onhandige reactie van cellen op de situatie, vertelt Nollen. “Een cel ziet dat er van alles misgaat: eiwitten hopen zich op en plakken aan elkaar. Dan slaat de cel alarm en zet de aanmaak van nieuwe eiwitten stop.” Zo’n productiestop kan tijdelijk nuttig zijn, bijvoorbeeld bij blootstelling aan hitte, waar eiwitten bijzonder slecht tegen kunnen. Maar bij veroudering is de situatie chronisch en gaat de productie van nuttige eiwitten permanent haperen. “De cel denkt constant dat 'ie onder stress staat. Dan is de reactie schadelijker dan de kwaal.”
Te druk
Wat er precies aan de hand is, bepaalt ook het beste antwoord op de eiwitklonters - en dus de aanpak van deze neurodegeneratieve aandoeningen. Als de reactie van lichaamscellen de meeste ellende veroorzaakt, helpt het wellicht om het alarmsysteem te dempen, denkt Nollen. De cel blijft dan meer nuttige eiwitten produceren, waardoor de klachten kunnen afnemen. Nadeel is dat ook de aanmaak van probleemeiwitten dan gewoon doorgaat, maar het nettoresultaat zou positief kunnen zijn.
Maar kunnen we het probleem niet bij de kern aanpakken? De grote vouwfabriek van een cel heeft de oplossing mogelijk zelf in huis. Die produceert namelijk ook eiwitten die de kwaliteit van andere eiwitten controleren, vertelt Anne Wentink van de Universiteit Leiden. Zij onderzoekt zulke chaperonne-eiwitten. “Chaperonnes herkennen eiwitten waarbij hydrofobe aminozuren zichtbaar zijn. Die horen binnenin de structuur te zitten.” Als een bouwplaat goed gevouwen is, zie je geen plakrandjes: bij een eiwit horen alle waterafstotende aminozuren onderling tegen elkaar geplakt te zitten. “De chaperonnes die ik onderzoek werken als een soort resetknop. Ze helpen met het ontvouwen van de verkeerde structuur, waardoor die een nieuwe kans krijgt om goed te vouwen.”
In de basis kunnen de chaperonnes zelfs samengeklonterde eiwitslierten weer opruimen, ook die hebben namelijk de verkeerde structuur. Ze lijken dat op jonge leeftijd nog prima te behappen, maar krijgen het er vanaf een bepaalde leeftijd vooral te druk voor. De klonten vormen zich sneller dan de controle-eiwitten kunnen repareren, ook omdat die met de jaren minder vitaal worden. “Het aantal chaperonnes blijft met de jaren vrij constant, maar je lichaam stapt over op systemen die minder energie gebruiken. Die kunnen minder grote reparaties doen bij andere eiwitten.”
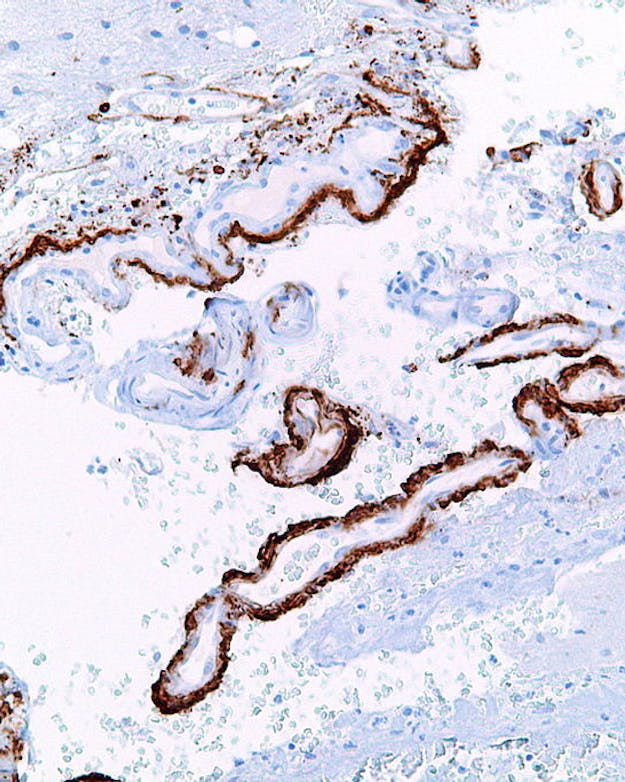
Sterk vergrote foto van hersencellen met samengeklonterde slierten van bèta-amyloïde, het eiwit verantwoordelijk voor alzheimer.
Wikimedia Commons, Nephron via CC BY-SA 3.0Meer of minder bescherming
Daar lijkt een tweede oplossingsrichting zichtbaar: de knutselplaats instrueren om meer krachtige chaperonnes te bouwen. Als verkeerd gevouwen eiwitten eerder worden getackeld, smoort dat het samenklonteren in de kiem. Dat ons lichaam nu geen extra energie steekt in kwaliteitscontroles door chaperonne-eiwitten is mogelijk vooral een soort bezuinigingsmaatregel. We zijn evolutionair gezien niet gericht op het bereiken van een hoge leeftijd. Oermensen konden hun energie wel beter besteden: een spiervezel extra leverde op korte termijn meer op dan extra controleurs. Maar nu hebben we eerder te veel dan te weinig energie, dus kunnen we ons best wat extra chaperonnes veroorloven.
Toch kan dat weleens verkeerd uitpakken, voorziet Wentink. Zij onderzoekt de fundamentele mechanismen van de controle-eiwitten en zag in reageerbuisjes iets onverwachts gebeuren. Zodra chaperonnes de eiwitplakkaten opruimen, lijken de controleurs juist onbedoeld ellende te veroorzaken. “De chaperonnes proberen kortere delen los te trekken uit de eiwitstreng. Daarbij lijken ze niet te herkennen of die aan een uiteinde zitten of ergens middenin. Af en toe trekken ze een deel uit het midden los, waardoor de hele structuur in stukken breekt.” De labresultaten zijn nog niet in de praktijk aangetoond, maar bieden nog een mogelijke verklaring voor neurodegeneratieve ziekten: waar de vouwfouten in elk geval gestructureerd lagen weggeborgen, belanden ze verspreid over de cel, met alle plakkerige gevolgen van dien.
Het lijkt nogal een tegenvaller: wat een oplossing lijkt, brengt mogelijk extra ellende. Niet méér maar minder chaperonne-eiwitten zouden neurodegeneratieve aandoeningen in een bepaald stadium kunnen vertragen. Maar Wentink ziet het vooral als een waardevolle les. Een simpel recept om alle vouwfouten te voorkomen is er waarschijnlijk niet, daarvoor komt de afstelling van cellen te gevoelig. Maar nu we steeds meer weten over eiwitten en hun beschermingsmechanismen, kunnen we de aftakeling van cellen op den duur mogelijk wel vertragen. “Misschien moet je een bepaalde hoeveelheid schade op de koop toenemen. Als dat inhoudt dat je twintig jaar langer zonder alzheimer kan leven, dan wegen de voordelen duidelijk op tegen de nadelen.”

